肠道微生物如何影响抗癌效果?《自然》子刊联合四十余位科学家揭示关键机制
一项发表于国际顶级学术期刊《自然》子刊的重磅研究,为癌症治疗领域带来了突破性见解。来自全球多个顶尖研究机构的四十余位科学家共同发布的研究成果,首次系统性地揭示了肠道微生物群影响癌症免疫治疗效果背后的深层生物学原因。这项研究不仅深化了我们对“肠-癌轴”的理解,也为未来开发基于微生物组的个性化抗癌疗法提供了坚实的科学基础。
长期以来,临床观察发现,不同癌症患者对同一种免疫检查点抑制剂等抗癌药物的反应存在巨大差异。越来越多的证据将这种差异指向了一个意想不到的“器官”——肠道及其内部数以万亿计的微生物。微生物究竟通过何种具体机制来“遥控”远端的肿瘤微环境,始终是悬而未决的核心谜题。
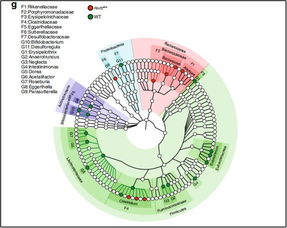
此次联合研究团队通过整合多组学分析、动物模型实验以及临床患者数据,成功“实锤”了其中的关键通路。研究发现,特定的肠道菌群及其代谢产物,能够通过血液循环系统,直接或间接地调节人体全身性的免疫状态。具体而言,某些有益菌株可以代谢膳食纤维,产生短链脂肪酸(如丁酸)等小分子物质。这些物质不仅能增强肠道屏障功能,减少全身炎症,还能作为信号分子,促进骨髓中具有抗肿瘤活性的免疫细胞(如特定的T细胞亚群)的分化与增殖。
反之,当肠道菌群失调,有害菌占据优势时,则可能产生促炎代谢物,抑制免疫系统的抗癌功能,甚至直接削弱药物疗效。研究团队精准鉴定出了几类与积极治疗反应呈正相关或负相关的细菌类群及其特征代谢物图谱,为预测患者疗效提供了潜在的生物标志物。
该研究隶属于“自然科学研究和试验发展”范畴,其成果是基础科学向临床医学转化的典范。它从分子和细胞层面,将复杂的微生物生态系统与宿主的系统性免疫应答连接起来,阐明了微生物影响抗癌效果的因果链条。这一发现具有重大的应用前景:医生或许可以通过分析患者的肠道菌群构成,提前预测其对免疫疗法的敏感性;更进一步,通过饮食干预、益生菌/益生元补充、甚至粪便微生物移植(FMT)等手段,有目的地塑造“有益”的肠道微生态,从而增强现有抗癌疗法的效果,或帮助那些原本对治疗无反应的患者重获希望。
这项由大规模国际合作完成的研究,标志着我们在利用人体内共生微生物对抗癌症的道路上迈出了关键一步。它证实了肠道不仅是消化器官,更是人体健康的“战略指挥部”之一。随着研究的深入,以微生物组为靶点的“协同抗癌”策略,有望成为肿瘤精准治疗新时代的重要支柱。
如若转载,请注明出处:http://www.baimeixi.com/product/52.html
更新时间:2026-02-24 16:40:13